高中六大强酸:酸性的秘密与应对
强酸的定义
强酸是指在水中完全离解的酸,能产生大量的氢离子(H+)。酸的强弱程度与溶液中H+的浓度成正比,H+浓度越高,酸越强。
强酸的性质
强酸具有以下特点:
1. 强酸在水中完全离解,产生大量的H+离子。
2. 强酸能与金属、金属氧化物、碱、盐等反应。
3. 强酸能中和碱,与碱发生中和反应。
4. 强酸能与金属氧化物发生反应,形成盐和水。
5. 强酸能与碱性氧化物发生反应,形成盐和水。
6. 强酸具有腐蚀性,对许多材料有腐蚀作用。
强酸的应用
强酸在生产和生活中有广泛应用,以下是几个常见的强酸应用:
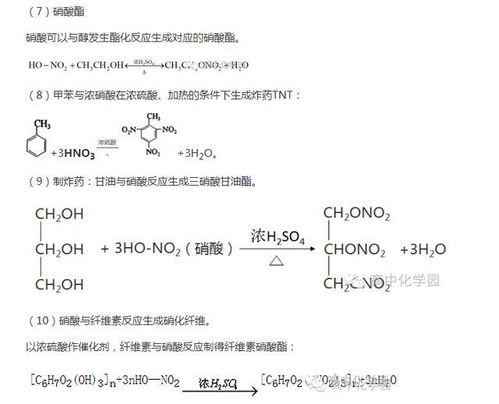
1. 盐酸:用于金属清洗、除锈、刻蚀等。
2. 硝酸:用于金属清洗、除锈、制造肥料、生产硝基化合物等。
3. 硫酸:用于金属清洗、除锈、制造肥料、制备有机酸等。
4. 氢氟酸:用于金属清洗、除锈、刻蚀、制备氟化合物等。
5. 盐酸酸化:用于检验卤素离子、酸化金属离子等。
强酸的危害
强酸具有强烈的腐蚀性,能对许多材料造成严重损害。强酸在生产过程中,如不采取防护措施,会对人体和环境造成危害。
1. 强酸沾到皮肤或衣物上,会引起化学灼伤。
2. 强酸沾到眼睛或口腔上,会引起刺激和灼痛。
3. 强酸若被误服,会引起严重腹泻、呕吐和脱水。
4. 强酸会污染水源和土壤,对生态系统造成损害。
如何应对强酸的危害
1. 穿戴防护衣物,避免强酸直接接触皮肤。
2. 注意化学安全,避免与强酸发生碰撞。
3. 如有酸沾到皮肤或衣物上,应立即用大量水冲洗,并涂上3%~5%的碳酸氢钠溶液。
4. 误服强酸后,应立即大量饮水,并送医院治疗。
5. 加强酸污染水源和土壤的监测,采取有效措施防止其对环境造成损害。
强酸的制备与分离
强酸的制备与分离需要采用相应的工艺和设备。以下是制备和分离强酸的常见方法:
1. 合成法:利用化学原料,如氢氧化钠、硝酸、盐酸等,合成出强酸。
2. 复分解法:利用酸和碱发生中和反应,制备出强酸。
3. 置换法:利用金属置换出酸中的氢离子,制备出强酸。
4. 精馏法:根据强酸与其他物质的沸点差异,进行分离。
强酸的用途及注意事项
强酸在生产和生活中有广泛应用,但使用时需注意其特性及安全注意事项。以下是强酸的一些常见用途及其注意事项:
1. 金属清洗:强酸可与金属氧化物反应,去除金属表面的污垢。但需注意,金属氧化物也可能与强酸发生反应,产生新的金属盐,因此应根据具体需求选择适当的酸。
2. 除锈:强酸可与金属氧化物反应,去除锈迹。但需注意,某些金属氧化物对强酸具有保护作用,不能将其完全去除,以免影响设备的性能。
3. 制造肥料:强酸可与碱性物质反应,生成富含氮、磷、钾的肥料。但需注意,肥料中的营养元素可能对土壤和生态环境产生不良影响,因此应合理施用。
4. 制备有机酸:强酸可与醇或醚等有机物发生酯化反应,制备出有机酸。但需注意,有机酸的结构和性质与无机酸有很大差异,应根据具体需求选择适当的酸。
强酸在生产和生活中具有重要作用,但使用时需注意其特性及安全注意事项。

- 声明:本文内容来自互联网不代表本站观点,转载请注明出处:bk.0755org.com/13/168077.html
